הדרך הטובה ביותר למנוע ולהסיר זיהומים היא באמצעות פעולת ה'עיקור' הטבעית של התגובה החיסונית המשלבת אלמנטים של חסינות מולדת וסתגלנית כאחד כדי להדוף פתוגנים זרים ללא התערבות רפואית. מערכת החיסון 'זוכרת' את האנטיגנים הזרים שהתנקו כדי להאיץ את תגובתה לזיהום חוזר. מערכת החיסון ברוב חולי הסרטן עדיין יכולה להרוס לחלוטין וירוסים וחיידקים. ניתן לראות את האכזריות והספציפיות של תגובה זו באופן שבו מערכת חיסונית מדוכאת לא מספקת יכולה להרוס לחלוטין איבר מושתל גדול, תוך שמירה על הרקמות (העצמיות) של האדם עצמו. השפעה הרסנית זו תהיה מועילה לטיפול בסרטן אם היא יכולה להיות מכוונת לגידולים.
תחום האימונותרפיה מחפש שיטות לרתום, לכוון ולשלוט בחסינות זו במיוחד נגד סרטן. חיסונים טיפוליים לסרטן הם סוג של אימונותרפיה שנועדה לחנך את המערכת החיסונית של חולים עם סוגי סרטן קיימים לזהות את תאי הגידול שלהם כזרים ולא כעצמיים. אם תצליח, תגובה חיסונית יכולה תיאורטית לעורר תאי חיסון להשמיד גידולים גדולים, וגם לחפש ולהרוס תאי גידול גרורתיים. לאחר טיפול אימונותרפי, היכולת של מערכת החיסון 'לזכור' תאי גידול אמורה לבטל כל הישנות ללא טיפול נוסף, באותה מידה שהיא מגינה מפני זיהומים אופורטוניסטיים.
המערכת החיסונית מבטיחה חיסול מלא של הגידול והפוגות עמידות עם חיסוני סרטן מתוכננים כהלכה
אימונותרפיה היא אלטרנטיבה (או משלימה) רצויה מאוד לאסטרטגיות הטיפול הנוכחיות. בניגוד למנגנונים אנטי-גידוליים בתיווך חיסוני, לניתוח, להקרנות ולכימותרפיה אין ספציפיות אנטי-גידולית ברמת התא הבודד. לכן, אין זה אפשרי מבחינה טכנולוגית לחסל כל תא סרטני אחרון, שבלעדיו מתרחשת בדרך כלל הישנות הסרטן. יתר על כן, שיטות אלו מובילות להתנגדות ולא ל"זיכרון" של הגידול.
המערכת החיסונית מבטיחה חיסול מלא של הגידול והפוגות עמידות עם חיסוני סרטן מתוכננים כהלכה. הספציפיות שלו במיקוד לתאים ממאירים והימנעות מתאי נורמליים מבטיחה גם רעילות מינימלית. זוהי הגישה היחידה הקיימת כיום שיש לה את האפשרות הטכנית לרפא סרטן.
מצב התפתחות אימונותרפיה נוכחי
היכולת לחנך את מערכת החיסון להסיר את כל התאים הסרטניים הצליחה בחלק מהמודלים של בעלי חיים. ניתן לחסן עכברים כדי לדחות גידולים מושתלים סינגניים ולהגן מפני אתגר מחדש של הגידול ללא טיפול נוסף, בעוד עכברים לא מחוסנים מתים תמיד. ההגנה היא ספציפית לגידול, שכן עכברים מחוסנים נכנעים לאתגרים מגידולים שונים. תאי T ציטוטוקסיים מסוג CD8+ ספציפיים לגידול (CTL) אחראים בעיקר לחיסול הגידול. יתר על כן, CTLs יכולים לזהות באופן ספציפי תאי גידול ואינם תוקפים תאים נורמליים מאותה רקמה.
בעוד שמחקרים אלה בבעלי חיים מספקים "הוכחה לקונספציה" לתרגום שיטות אלה למרפאה, קשה היה לממש את ההבטחה של אימונותרפיה. בשני העשורים האחרונים תוכננו אסטרטגיות אימונולוגיות כדי לעורר חסינות נגד גידולים בחולי סרטן, על ידי חיסון עם תאים דנדריטים עם פעימות פפטיד או ליזאט גידול, אימונותרפיה בתיווך ציטוקינים, מתן מספר רב של תאי T שנוצרו מגידול. חודרים לימפוציטים או מהונדסים לבטא קולטנים לאנטיגנים ספציפיים הקשורים לגידולים (TAA), 'DNA עירום', ווירוס רקומביננטי. למרות ניסיונות רבים, שיעור ההצלחה של אימונותרפיה קלינית נותר נמוך באופן תהומי. עם זאת דיווחים מעודדים על ניסויים מוצלחים בשימוש בחיסוני סרטן חדשים בהארכת הישרדות בסרטן הערמונית ממחישים את הפוטנציאל של גישה זו, אם כי התוצאות נופלות בהרבה מהפוטנציאל המרפא.
למרות התוצאות הקליניות הדלות, עשרות ניסויים קליניים של חיסון נגד סרטן נערכים כיום על ידי נותני חסות תעשייתיים ואקדמיים כאחד. אחת הסיבות להמשך הפיתוח והבדיקה של חיסונים נגד סרטן היא הדרישה לחלופות לתחלואה הגבוהה הקשורה לשיטות טיפול אחרות, שכן לאימונותרפיה יש רעילות מועטה. בעוד ששיעורי התגובה לכימותרפיה רעילה מאוד השתפרו במהלך שני העשורים האחרונים, העלייה המתונה בהישרדות של 5 שנים [1] גבתה מחיר חמור מבחינת איכות החיים.
פגמים בפיתוח חיסון נגד סרטן
הכישלון של מאות ניסויים קליניים אימונותרפיים לייצר פעילות אנטי-גידולית משמעותית מחייב בחינה מחדש של העקרונות הבסיסיים. במשך למעלה מ-200 שנה, חיסונים שימשו בהצלחה למניעת מחלות זיהומיות רבות על ידי גרימת תגובה הומורלית (נוגדנים). אותה תפיסה מיושמת לפיתוח חיסוני סרטן מתוך כוונה לטפל בגידולים קיימים, למרות העובדה שחיסונים הנותנים הגנה מפני זיהום פתוגני אינם מסוגלים לרפא זיהומים קיימים עם אותו פתוגן. לפיכך, מודלים של טיפול בסרטן על בסיס חסינות מגן פגומים ביסודו כאסטרטגיה מכיוון שחסינות מגן אינה מספקת חסינות טיפולית. חסינות טיפולית לסרטן דורשת תגובה חיסונית תאית.
חיסון לסרטן עקב אחר אסטרטגיות התפתחות קלאסיות על ידי התמקדות במציאת אנטיגנים ייחודיים על גידולים שאינם נמצאים על תאים נורמליים, כלומר אנטיגנים ספציפיים לגידולים (TSA), או על ידי חיפוש אנטיגנים הקשורים לגידול (TAA) המובעים יתר על המידה על ידי תאים סרטניים. TSAs נמצאו רק בגידולים המושרים על ידי גורמים זיהומיים (למשל אנטיגן EBNA-1 מלימפומה של Burkitt המושרה על ידי נגיף Epstein Barr). עם זאת, זוהו TAAs רבים, כולל CEA, MUC1, HER-2/neu וחלבון α-עובר, שחלקם מתבטאים על סוגי גידול רבים, אך לא על רקמות תקינות, למעט spermatogonia (למשל, משפחת MAGE, משפחת GAGE ואנטיגנים של NYESO-1). TAAs הם אנטיגנים עצמיים ולכן אינם מסמנים גידולים כזרים, אך בכל זאת מאפשרים הבחנה אימונולוגית בין תאים גידוליים לתאים נורמליים.
חיסונים לסרטן המכילים TAA יכולים להכיל גם חומרים המגבירים את יכולתם של אנטיגנים אלה לעורר תגובות חיסוניות אנטי-גידוליות. אלה כללו תערובת עם אדג'ובנטים אימונולוגיים (כגון MF59, אדג'ובנט לא שלם של פרוינד, ספונינים QS-21 ו-Bacillus Calmette-Guerin [BCG]), סינתזה של נגזרות אימונוגניות יותר, צימוד לחלבונים אימונוגניים ופעימות ישירות לתאים דנדריטים, אך ללא הצלחה יתרה.
הצורך הנתפס ב'הגדלה' של TAA מבוסס על ההנחה שמכיוון ש-TAA נגזרים מרקמות עצמיות, ולא מפתוגנים זרים כמו בחיסונים קודמים, הם חלשים יחסית. שיטות המשפרות את האימונוגניות של TAA נחשבות חיוניות ליצירת תגובות חזקות יותר שיכולות להיות בעלות השפעה אנטי-גידולית קלינית. ההנחה היא שסרטן היא מחלה של מערכת חיסונית מוחלשת ולכן נדרשות שיטות ל'חיזוק' מערכת החיסון לטיפול בסרטן. האימונולוגיה המסורתית לימדה אותנו שהמטרה העיקרית של מערכת החיסון היא להבחין בין "עצמי" ל"לא-עצמי", ומכיוון שסרטן הוא "עצמי", לא צריכה להיות תגובה חיסונית נגדו, מושג שהוא גם ביסודו פגום.
סרטן: מחלה של מערכת חיסונית חלשה?
כאשר תא תקין הופך לתא גידולי, שינויים המתרחשים בביטוי פני השטח של אנטיגנים גורמים ל-TAAs שבאופן תיאורטי ניתן לזהות על ידי תאי חיסון. ארליך טען לראשונה ב-1909 שמערכת החיסון מגנה על המארח מפני סרטן, מושג ששונה בשנות ה-50 על ידי לואיס תומס ואחר כך על ידי חתן פרס נובל סר מקפרלן ברנט, שהציע שלמערכת החיסון יש מנגנון "מעקב" לחיסול טרום סרטני וסרטני. תאים. העיקרון הבסיסי של השערה זו הוא שגידולים מתעוררים כל הזמן בגוף ומערכת החיסון חייבת לזהות ולחסל תאים המבטאים TAAs. הוא צופה שבנסיבות שבהן המערכת החיסונית נחלשת או מדוכאת, המעקב נפגע, תאי הגידול תופסים אחיזה והתוצאה היא מחלה קלינית. זה היה הבסיס שעליו המערכת החיסונית במקרי סרטן נתפסת כחלשה, ולכן יש לחזק את המערכת החיסונית כדי להתקף נגד סרטן. עם זאת, ישנן עדויות רבות להיפך.
בעוד שכמה סוגי סרטן נדירים מתרחשים אצל אנשים עם דיכוי חיסוני, רוב סוגי הסרטן האנושיים נוצרים אצל אנשים בעלי יכולת חיסונית. בנוסף, אין ספק שלניאופלזמות רבות, במיוחד אלה שמקורן באפיתל, יש מרכיב משמעותי של תאים דלקתיים. זה כולל חדירת לויקוציטים מגוונת של מקרופאגים, נויטרופילים, אאוזינופילים ותאי פיטום, לעתים קרובות בשיתוף עם לימפוציטים. גידולים חודרים בדרך כלל בשפע עם תאי חיסון, מה שמתווכח נגד הכרה חלשה של האנטיגנים שלהם. יתר על כן, ניסיונות רבים להגביר את התגובה החיסונית משפרים ולא מדכאים את צמיחת הגידול [2,3]. בעכברים, ניתן לעורר גידול באתרו החדש, שנגזר מנזכימלית ואפיתל, לגדול מהר יותר אם הוא יוצר תגובה חיסונית. אפילו גידולים אימונוגניים מאוד שנותרו ללא הפרעה במארחים המקוריים שלהם יכולים לגדול מהר יותר מגידולים בעלי אימונוגניות מועטה או ללא. לכן, הרעיון שגידולים "בלתי נראים" למערכת החיסונית, ולכן צריך לחזק אותה, הוא מוטעה. ייתכן שהבעיה היא שהתגובה החיסונית לגידול, למרות שהיא חזקה, עשויה להיות מהסוג הלא נכון. בניסיון להגביר תגובה חיסונית שכבר לא הצליחה להגן מפני היווצרות גידול, אין זה מפתיע שצמיחת הגידול עשויה להשתפר ולא לדכא. זהו פגם נוסף באסטרטגיה של פיתוח חיסונים לסרטן.
תגובה חיסונית נכונה מול שגויה לסרטן
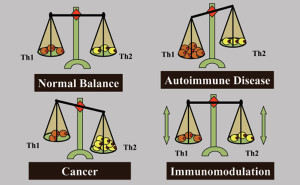
לפני תכנון חיסון לסרטן בעל פוטנציאל טיפולי, יש להבין את סוג החסינות הנדרשת לחיסול הגידול. תגובות חיסון מתוארות בדרך כלל על ידי שתי תגובות מקוטבות, T-helper type 1 (Th1) ו-T-helper type 2 (Th2). תגובת Th1 מתווכת חסינות תאית והיא קריטית למיגור גידול בתיווך חיסוני; תגובת Th2 מתווכת חסינות הומורלית, סוג החסינות שיכולה להגן מפני מחלות זיהומיות מסוימות, אך היא תגובה "שגויה" או בלתי הולמת לגידול. סטייה מתווכת גידול של התמיינות תאי T-helper ל-Th2 היא אסטרטגיית גידול להימנעות חיסונית והישרדות. למעשה, ניתן לזהות תגובת Th2 לא יעילה ברוב החולים עם סרטן מתקדם ומחלה גרורתית. זה מסביר מדוע פשוט חיזוק התגובה החיסונית בחולי סרטן נכשל, שכן זה רק משמש לשיפור תגובת Th2 תושבת שכבר לא הצליחה להגן מפני היווצרות גידול ואינה מסוגלת למגר סרטן.
תגובות Th1 ו-Th2 הן נוגדות רגולציה, תגובות Th1 מוגברות מפחיתות ויסות של תגובות Th2 ולהיפך. לכן, אנו מציעים שתפקיד אחד של מועמד מוצלח לחיסון סרטן יהיה להימנע מהגברת תגובת Th2 "שגויה" קיימת, וליצור דה נובו תגובה "נכונה" מופרזת של Th1 לגידול המספיקה להורדת תגובת Th2. האתגר יהיה ליצור תגובת Th1 זו כנגד תגובת Th2 תושבת מוחצת בתיווך גידול ומנגנונים טבעיים המדכאים הרס אוטואימוני של רקמות תקינות. עם זאת, סטייה של התגובה החיסונית האנטי-גידולית מתגובת Th2 לתגובת Th1 יכולה להיות רק חלק מאסטרטגיה אפשרית לחסינות טיפולית אנטי-גידולית. בעוד שחסינות Th1 חיונית למיגור הגידול, אצל חלק מהחולים שמפתחים תגובת Th1 שעלולה להיות יעילה נגד גידולים (או שניתן לחסן אותם לפתח כזה), הגידולים שלהם המשיכו לגדול. זה מראה שגידולים מצליחים לדכא או להימנע מתגובת Th1 מגוננת. בהתאם, אסטרטגיית אימונותרפיה מוצלחת לא תצטרך רק לשפר את חסינות Th1 ולדכא את חסינות Th2, אלא חייבת להשבית את ההימנעות החיסונית מתגובת Th1 ולנטרל מעגלי סובלנות טבעיים המונעים הרס חיסוני של רקמות תקינות.
הימנעות חיסונית מגידולים

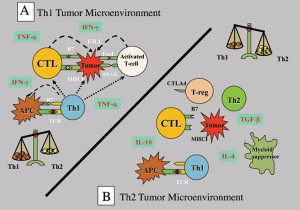
לגידולים יש מספר רב של מנגנונים פעילים לדיכוי חסינות Th1 המארח, כולל שינוי תפקודם של APCs, טיפוח איתות משותף של תאי T לא מתפקדים, יצירת סביבת ציטוקינים Th2 חתרנית חיסונית, הורדת וויסות מולקולות HLA וגיוס DCs סובלני ותאי מדכא מיאלואיד. רבים מהמנגנונים המעכבים חסינות אנטי-גידולית מביאים להתפתחות של תאי T וויסות (Treg). תאי Treg אלה הם מנגנון הבריחה החיסוני הדומיננטי בהתקדמות הגידול המוקדמת. בנוסף, רוב תאי הגידול האנושיים מייצרים רמות גבוהות של גורם גדילה מתמר (TGF)-β שיכולים להמיר ישירות תאי T נאיביים לתאי Treg. TGF-β גם מדכא את השעתוק של גנים המקודדים לחלבוני מפתח מרובים של תאי T ציטוטוקסיים CD8+ (CTL), כגון המולקולות הציטוליטיות perforin ו-granzymes.
הימנעות חיסונית בתיווך גידול מעבירה ומקדם את מערכת החיסון לתגובת Th2 לא יעילה אשר הופכת אותה לסובלנית, ומאפשרת לגידולים לצמוח ללא הפרעה על ידי מנגנוני המעקב. ביסוס סובלנות עצמית הוא חלק ממנגנון ויסות חיסוני טבעי המונע תגובות אוטואימוניות לאנטיגנים עצמיים ספציפיים לאיברים. מנגנוני סובלנות רבים כאלה זהים לאלו המופעלים על ידי גידולים כדי למנוע הרס חיסוני.
לכן, תכונה נוספת של חיסון טיפולי מוצלח לסרטן היא היכולת להתגבר על מנגנוני הימנעות חיסוניים מסרטן ומנגנוני סובלנות טבעיים.
אסטרטגיה להתגבר על הימנעות חיסונית מסרטן
מכיוון שמערכת החיסון מתוכנתת להגיב באגרסיביות לאנטיגנים זרים, היא הביאה את האימונולוגים לגבי האופן שבו הריון מוצלח אפשרי. העובר זר לאם (התאמה 50%) ותאי החיסון של האם נתקלים באופן קבוע בתאים זרים של העובר, אך הם אינם מגיבים לתאים אלו. האינטראקציה בין הגידול למערכת החיסונית הושוותה להריון שבו שתל אלוגני (העובר) מתפתח במהירות ללא דחייה על ידי מארח מוכשר מבחינה אימונולוגית. יכולתו של העובר להתחמק מהתגובה החיסונית האימהית אינה נובעת ממחסומים אנטומיים, שכן תאי חיסון אימהיים חוצים את השליה ויכולים להיכנס לעובר. המנגנונים שבאמצעותם גידולים בורחים מהתקף חיסוני דומים לבריחה של היחידה העוברית האלוגנית, הכוללים אובדן או הורדה של מולקולות HLA, שינוי פעילות ציטוקינים Th2, הפרשת גורמים מדכאים חיסוניים (כולל TGF-β), הפעלת Treg ודיכוי של חסינות Th1.
סובלנות לעובר אובדת אצל חלק מהנשים שחוות הפלה ספונטנית. מנגנון הפירוק של ההגנה החיסונית הטבעית עשוי, אם כן, להיות מאלף לתכנון חיסונים לסרטן. קיימת רשת ציטוקינים ייחודית בממשק האם-עובר הממלאת תפקיד מפתח בשמירה על ההריון. הריון מוצלח נמצא בקורלציה עם הטיית Th2 הן בממשק האם-עוברי והן בפריפריה. עם זאת, בהריון הנוטה להפלה, הטיית Th1 מתרחשת באופן מערכתי ובממשק האמה-עובר. כמו הממשק בין האם לעובר, גם תגובות דלקתיות מתמשכות בתוך הסטרומה של הגידולים נשלטות על ידי ציטוקינים Th2 שלא רק מקדמים את צמיחת הגידול, אלא מדכאים באופן עמוק את יכולתו של המארח ליצור תגובה חיסונית יעילה נגד Th1 אנטי-גידולית. זה מצביע על כך שהמרה של המיקרו-סביבה המערכתית והתוך-גידולית ל-Th1 עשויה לשבור את הסבילות החיסונית לגידול.
ניתן למצוא עדויות התומכות בתפיסה זו על ידי ניתוח ההשפעה החיסונית האנטי-גידולית החזקת המתרחשת במסגרת השתלת מח עצם/תאי גזע אלוגניים (BMT). תגובת השתל מול הגידול (GVT) היא ללא ספק הצורה החזקה ביותר של אימונותרפיה בסרטן בשימוש קליני. למעשה, השפעת ה-GVT המתרחשת על עירוי של לימפוציטים תורם בחולי CML עם הישנות גידול לאחר BMT אלוגני היא הדרך היחידה לרפא את המחלה.
היישום הקליני של GVT מוגבל, עם זאת, עקב מחלת שתל מול מארח (GVHD), סיבוך מסכן חיים של BMT אלוגני. תאי T בשתל התורם הם קריטיים בהשראת GVHD ו-GVT כאחד, מכיוון שדלדול תאי T מהשתלת מח העצם לא רק מונעת ביעילות GVHD, אלא גם גורמת להישנות סרטן תכופה יותר. גם GVT וגם GVHD מתווכים על ידי ייצור של ציטוקינים Th1, מה שמקשה להפריד בין השפעות ה-GVT המועילות להשפעות ה-GVHD המזיקות.
אפקט GVT אנטי-גידולי מספק הפוגה ארוכת טווח כאשר היא מתרחשת באמצעות פיתוח חסינות ספציפית לגידול Th1. זה מצביע על כך ש-GVT אינו רק תוצאה של מיגור הגידול על ידי הכרה אלוגניית. חסינות המגנה מפני הישנות הגידול ללא טיפול נוסף מעידה על התפתחות של חסינות אדפטיבית ספציפית לגידול. ואכן, CTL ספציפי לגידול שמקורו בתורם מתפתח במארח ותורם לאפקט GVT. לפיכך, שחרור ציטוקינים Th1 המתמשך המתרחש ב-BMT אלוגני עקב GVHD פועל כעזר ביצירת חסינות אנטי-Th1, שבירת סבילות חיסונית והשבתת דיכוי חיסוני הגידול שעלול לגרום להפוגה מתמשכת מהמחלה.
הבנת מנגנוני החיסון האנושיים המעורבים בהריון תקין ובהפלות ספונטניות מספקת מודל לתכנון תגובות חיסוניות של חיסון כדי להתגבר על סובלנות עצמית
בעבר תורגמו שיטות אימונותרפיה ממודלים של בעלי חיים למרפאה, אך ללא יעילות אנטי-גידולית משמעותית. הבנת מנגנוני החיסון האנושיים המעורבים בהריון תקין ובהפלות ספונטניות מספקת מודל לתכנון תגובות חיסוניות של חיסון כדי להתגבר על סובלנות עצמית. השפעת ה-GVT של BMT אלוגני מראה כיצד חסינות נגד גידול Th1 עשויה להתפתח בחולה סרטן דה נובו ואולי להתגבר על הימנעות חיסונית של הגידול.
רעיונות חדשים על פיתוח חיסונים לסרטן

דיון זה מספק השערת עבודה שיכולה להסביר את הכשלים באימונותרפיה במרפאה. גישות אימונותרפיה קודמות הסתמכו על הוכחת מושג מנתוני בעלי חיים שלא תורגמו היטב למרפאה; שיטות קלאסיות לפיתוח חיסונים המספקות חסינות מגנה ולא טיפולית, ואשר פעלו כדי לעורר תגובת Th2 לא יעילה או קידמו תגובה נגד גידול Th1 מבלי לנטרל מנגנוני הימנעות חיסוני של הגידול ומנגנוני סבילות טבעיים.
טיפול אימונותרפי מוצלח ידרוש המרה של תגובה חיסונית Th2 תושבת לתגובת Th1. פיתוח דה-נובו של תגובת Th1 שמציפה ומשביתה את תגובת Th2 התושבת אפשרית אם אנטיגנים מוכנסים בנוכחות ציטוקינים Th1, כפי שמתרחש באפקט ה-GVT המרפא לאחר BMT אלוגני. נוכחותם של ציטוקינים Th1 יכולה להניע תאי T לא מחויבים לפתח פרופיל ציטוקינים Th1, תוך עיכוב בו-זמנית של תאים עם הפנוטיפ ההדדי; למשל IFN-γ, ציטוקין Th1, יכול להרחיב באופן סלקטיבי תאי Th1 ולעכב שגשוג של תאי Th2. יתר על כן, שבירת הסבילות לרקמות אוטולוגיות אפשרית גם בסביבה דלקתית Th1 מתמשכת, כפי שמעידה על הפלה ספונטנית בתיווך Th1 ו-GVHD בתיווך Th1, הפועלת כתוסף להשפעה המרפאת נגד הגידול Th1 בהליכי BMT אלוגניים.
מנגנונים אלו עולים בקנה אחד עם התפיסה החדשה שנקראת "תיאוריית הסכנה", אשר מציעה כי ויסות החסינות והסובלנות אינו נקבע על ידי הכרה של אנטיגנים עצמיים מול זרים כפי שחשבו בעבר, אלא על ידי ההקשר שבו האנטיגנים מוצגים בפני מערכת החיסון [4,5]. לפיכך, מפגש עם אנטיגן על ידי תאים דנדריטים (DC) בהקשר סביבתי דלקתי או 'מסוכן' גורם לתגובה חיסונית חזקה של Th1 ללא קשר לשאלה אם האנטיגנים הם ממקור עצמי או זר. לעומת זאת, לכידת אנטיגן על ידי DC בהקשר לא דלקתי מובילה בסופו של דבר לסובלנות חיסונית. גידול "מתנה" את המיקרו-סביבה לתגובה הסובלנית, אך כאשר תאים נורמליים נהרסים כמו ב-GVHD, תגובת Th1 פעילה מועדפת.
פרוטוקול חיסון ניסיוני חדש לסרטן
כדי לעורר חסינות אנטי-גידולית, יש צורך להנדס את המיקרו-סביבה שבה DCs מעבדים אנטיגנים של גידולים כדי להכיל מספיק "אותות סכנה" דלקתיים חזקים מספיק כדי להפחית את ייצור הציטוקינים המדכאים את מערכת החיסון בתיווך גידול ומנגנונים סובלניים קשורים. זה אמור לאפשר התפתחות של תגובה חיסונית Th1 נגד הגידול, שגודלו ומשך הזמן שלו ישלטו גם אם זה מספיק כדי להוריד את מנגנוני ההימנעות החיסונית של הגידול. הדבר תלוי בהיקף ובאיכות של התגובה הדלקתית המקומית ובשמירה על תגובה דלקתית מערכתית לאורך זמן כדי להשבית את ההימנעות החיסונית.
בהתבסס על מושגים שנגזרו ממנגנוני חיסון אנושיים ממשיים המובילים לחסינות מרפאת נגד גידולים ושבירת הסובלנות החיסונית הטבעית, אנו מציעים גישה חדשה לפיתוח חיסונים לסרטן, שהוכחה הוכחה למושג במודלים של גידולים בבעלי חיים [6,7] . לפרוטוקול שלושה שלבים נפרדים, הראשון שנועד להגדיל את מספר תאי חיסון Th1 במחזור הדם בחולי סרטן, ולהעביר את האיזון מ-Th2 ל-Th1. השני מעורר חסינות Th1 ספציפית נגד גידול. השלישי מסתמך על הפעלת רכיבים של התגובות החיסוניות המולדות והסתגלניות ליצירת סביבת ציטוקינים Th1 מתמשכת המווסתת את ההימנעות החיסונית (פרוטוקול NCT00861107; www.clinicaltrial.gov).
מרכיב המפתח הוא תרופה ניסיונית, AlloStimTM, המורכבת מתאי חיסון חוץ גופיים מובחנים ומורחבים של Th1 שמקורם בתורמי דם נורמליים. תאים אלה, המשמשים בסביבה לא תואמת בכוונה, מופעלים בזמן ההזרקה עם מיקרו-חרוזים מצומדים נוגדנים חד שבטיים אנטי-CD3/אנטי-CD28, ומייצרים כמויות גדולות של ציטוקינים דלקתיים תוך ביטוי מולקולות אפקטור על פני התא, למשל CD40L ו-FasL , שמקדמים את חסינות Th1.
כדי להגביר את מספר תאי Th1 במחזור הדם בחולי סרטן, תאי AlloStimTM יוזרקו לעור מדי שבוע. אלואנטיגנים המבוטאים על תאים זרים צריכים לעורר תגובת דחייה חיסונית חזקה. בנוסף, הביטוי של ציטוקינים Th1 על ידי AlloStimTM יספק סביבת אדג'ובנט דלקתית המנתבת את התגובה החיסונית לאלואנטגנים בתאי AlloStimTM לחסינות זיכרון Th1. הזרקות מרובות צפויות לפעול כזריקות דחף, ולהגדיל את מספר תאי הזיכרון Th1 במחזור הספציפיים לאלואנטגנים.
כדי לחנך את המערכת החיסונית לאיום הנשקף מהגידול, ולהגיב על ידי פיתוח חסינות Th1 ספציפית לגידול, מוצע שילוב של AlloStimTM עם קריואבלציה של הגידול. על ידי שילוב של מוות גידול פתולוגי8 על ידי קריואבלציה עם AlloStimTM תוך-גידולי המייצר אותות סכנה דלקתיים, נקבעים התנאים ליצירת חסינות ספציפית לגידול Th1. בדרך כלל תאים בגוף מתים באפופטוזיס, חלק מתמשך מתחלופת התאים. מערכת החיסון אינה מגיבה לתאים אפופטוטיים, ובכך נמנעת מאוטואימוניות. רוב הסוכנים הכימותרפיים גורמים למוות של תאי גידול באותו תהליך אפופטוטי [9]. קריואבלציה של הגידול גורמת למוות על ידי נמק, ומשחררת את התוכן הפנימי של תאים רבים בו זמנית לתוך המיקרו-סביבה המספקים אותות "אכלו אותי" לתאי החיסון שגויסו לאתר. על פי תיאוריית הסכנה, ניתן לתכנת DCs במיקרו-סביבה להתבגרות, מה שמקדם התפתחות של חסינות Th1 ספציפית לאנטיגנים הנבלעים.
עם תאי זיכרון Th1 מוגברים במחזור הדם ו-CTLs ספציפיים לגידול, השלב האחרון הוא מתן AlloStimTM בעירוי תוך ורידי. התאים האלוגניים הבלתי תואמים בכוונה במארחים בעלי יכולת חיסונית שנועדו לאלואנטגנים אמורים לעורר דחייה חזקה. זה ייצור סביבה אימונולוגית דומה לסביבת GVHD בהשתלות אלוגניות [10]. עם זאת, דחייה של תאים אלוגניים אינה צפויה להיות רעילה.
CD40L (CD154) המובע על פני השטח של AlloStimTM אמור לקיים אינטראקציה עם CD40 המבוטא באופן מכונן על אבות hematopoietic המארח, תאי אפיתל ואנדותל, וכל APC, DC, מונוציטים מופעלים, לימפוציטים B פעילים, DCs זקיקים ותאי NK. CD40L הוא מעורר חזק של תגובות Th1 והגירוי שלו מבטל את ההשפעה המדכאת של תאי Treg. זה גם מפעיל תאי NK ו-DCs מולדים. הפעלת CD40-CD40L של DCs מובילה להתבגרות ולוויסות-על של מולקולות קו-סטימולטוריות, לייצור כמויות גדולות של IL-12 בעל תכונות אנטי-גידול חזקות ומכוונות Th1. ל-CD40L יש גם השפעות נוגדות גידול ישירות על ידי דיכוי הצמיחה והשראת מוות נרחב של תאים [11-13]; ההפעלה שלו משפרת בנוסף תמוגה של גידולים בתיווך CTL.
ציטוקינים Th1 המיוצרים על ידי ביטוי AlloStimTM ו-CD40L מפעילים גם תאי Th1 אלוספציפיים במחזור שנוצרים בשלב הראשון של הפרוטוקול, ובכך מקיימים את הסביבה הדלקתית הדרושה להורדת ויסות ההימנעות החיסונית ומאפשרים ל-CTL הספציפי לגידול שנוצר בשלב השני של הפרוטוקול לתווך אנטי. -השפעות הגידול.
פרוטוקול זה המשלב את המושגים החדשים הללו לפיתוח חיסוני סרטן עומד להיבדק במרפאה. התוצאות עשויות בבוא העת לקרב אותנו למימוש ההבטחה של אימונותרפיה בסרטן.
1. Morgan G, Ward R, Barton M. התרומה של כימותרפיה ציטוטוקסית להישרדות של 5 שנים בממאירות במבוגרים. Clin Oncol (R Coll Radiol) 2004;16:549.
2. קורות חיים אחים. ביקור מחדש במעקב חיסוני וסטימולציה חיסונית: השלכות על אימונותרפיה בסרטן. J Transl Med 2005;3:8.
3. Prehn RT, Prehn LM. אימונוסטימולציה של סרטן לעומת מעקב חיסוני. Medicina (B Aires) 1996;56(1):65.
4. מצינגר פ' מבוא לסדרה. מודל סכנה של חסינות. Scand J Immunol 2001;54:2.
5. Janeway CA, Jr. מערכת החיסון התפתחה כדי להבחין בין אי-עצמי מדבק מעצמי שאינו מדבק. Immunol Today 1992;13:11.
6. Har-Noy M, Zeira M, Weiss L, Slavin S. תאי זיכרון T1 צלב CD3/CD28 מוצלבים לחלוטין מעוררים השפעות אנטי-לוקמיה במארחים לא מותנים ללא רעילות GVHD. Leuk Res 2008;32(12):1903.
7. Har-Noy M, Zeira M, Weiss L, Fingerut E, Or R, Slavin S. Allogeneic CD3/CD28 Th1 cross-linked cells מספקים השפעות אדג'ובנטיות חזקות לאימונותרפיה פעילה של לוקמיה/לימפומה. Leuk Res 2009;33(4):525.
8. אבלין ר"ג. הערכה ומימוש של מושג ה-Cryoimmunology, עמ'. 136. באוניק, ג"מ; רובינסקי, ב.; Watson, G. and Ablin, RJ (עורכים): Percutaneous Prostate Cryoablation. Quality Medical Publishing, Inc., St. Louis, 1995.
9. חנון י.א. אפופטוזיס והדילמה של כימותרפיה בסרטן. Blood 1997;89:1845.
10. Har-Noy M, Slavin, S. ההשפעה האנטי-גידולית של השתלת מח עצם/תאי גזע אלוגני ללא שתל לעומת רעילות מחלת המארח וללא דרישת תורם מותאמת? Med. השערות 2008;70(6):1186.
11. Georgopoulos NT, Steele LP, Thomson MJ, Selby PJ, Southgate J, Trejdosiewicz LK. מנגנון חדשני של אפופטוזיס המושרה על ידי CD40 של תאי קרצינומה הכולל הפעלת TRAF3 ו-JNK/AP-1. מוות תאים שונה 2006;13:1789.
12. Georgopoulos NT, Merrick A, Scott N, Selby PJ, Melcher A, Trejdosiewicz LK. מוות בתיווך CD40 והפרשת ציטוקינים בסרטן המעי הגס: יעד פוטנציאלי להרג תאי גידול דלקתיים. Int J Cancer 2007.
13. Tong AW, Papayoti MH, Netto G, Armstrong DT, Ordonez G, Lawson JM, Stone MJ. השפעות מעכבות גדילה של ליגנד CD40 (CD154) והביטוי האנדוגני שלו בסרטן שד אנושי. Clin Cancer Res 2001;7:691.
• ריצ'מונד פרהן דן בבעיה זו בגיליון קודם של חדשות אונקולוגיה (Prehn RT. חיסון לסרטן או סתם משאלת לב? Oncology News 2006;1:8-10).




